Сообщение по биологии на тему Белки, их строение и роль в клетке
Строение и функции белков

Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Ничего непонятно?
Попробуй обратиться за помощью к преподавателям
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка.
Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры.
Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т.п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде.
При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов.Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра.
Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы.
Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра.
На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
Источник: https://spravochnick.ru/biologiya/himiya_zhizni/stroenie_i_funkcii_belkov/
Значение, роль и функции белков в клетке. Какую функцию в клетке выполняют белки?

Белки – это важнейшие органические вещества, количество которых преобладает над всеми другими макромолекулами, которые присутствуют в живой клетке. Они составляют больше половины веса сухого вещества как растительных, так и животных организмов. Функции белков в клетке разнообразные, некоторые из них до сих пор остаются неизвестными науке.
Но все же основные направления их «работы» хорошо изучены. Одни нужны для того, чтобы стимулировать процессы, протекающие в клетках и тканях. Другие переносят важные минеральные соединения через клеточную мембрану и по кровеносным сосудам от одного органа к другому. Некоторые защищают организм от чужеродных часто патогенных агентов.
Ясно одно — без белков не протекает ни один процесс в нашем организме.
Основные функции белков
Функции белков в организме многообразны. Каждая группа имеет определенное химическое строение, совершает одну специализированную «работу». В некоторых случаях несколько типов белков взаимосвязаны друг с другом. Они отвечают за разные этапы одного процесса. Или же влияют сразу на несколько. Например, регуляторная функция белков осуществляется ферментами и гормонами.
Это явление можно представить, вспомнив о гормоне адреналине. Он вырабатывается мозговым слоем надпочечников. Поступая в кровеносные сосуды, он повышает количество кислорода в крови. Поднимается и артериальное давление, увеличивается содержание сахара. Это стимулирует обменные процессы. Также адреналин является медиатором нервной системы у рыб, амфибий и пресмыкающихся.
Многочисленные протекающие в клетках живых организмов биохимические реакции осуществляются при высоких температурах и с нейтральным значением рН.
В таких условиях скорость их прохождения слишком мала, поэтому нужны специализированные катализаторы, называемые ферментами. Все их разнообразие объединено в 6 классов, которые различаются по специфичности действия.
Ферменты синтезируются на рибосомах в клетках. Их изучением занимается наука энзимология.
Несомненно, без ферментов невозможна регуляторная функция белков. Они обладают высокой избирательностью действия. Их активность может регулироваться ингибиторами и активаторами.
Кроме того, ферменты обычно проявляют специфичность по отношению к субстратам. Также ферментативная активность зависит от условий в организме и в клетках в частности.На их протекание влияет давление, кислая рН, температура, ионная сила раствора, то есть концентрация солей в цитоплазме.
Транспортная функция белков
В клетку должны постоянно поступать необходимые организму минеральные и органические вещества. Они нужны как строительные материалы и источники энергии в клетках. Но механизм их поступления достаточно сложен. Клеточные оболочки состоят не только из белков. Биологические мембраны строятся по принципу двойного слоя липидов. Между ними встроены различные белки.
Очень важно, что гидрофильные участки находятся на поверхности мембраны, а гидрофобные — в ее толще. Таким образом, такая структура делает оболочку непроницаемой. Через нее не могут самостоятельно, без «помощи», пройти такие важные компоненты, как сахара, ионы метолов и аминокислоты.
Через цитоплазматическую мембрану в цитоплазму их транспортируют специализированные белки, которые вмонтированы в слои липидов.
Но транспортная функция белков осуществляется не только между межклеточным веществом и клеткой. Некоторые важные для физиологических процессов вещества приходится доставлять из одних органов в другие. Например, транспортный белок крови – сывороточный альбумин.
Он наделен уникальной способностью сформировывать соединения с жирными кислотами, которые появляются при переваривании жиров, с лекарственными препаратами, а также со стероидными гормонами.
Важными белками-переносчиками являются и гемоглобин (доставляющий молекулы кислорода), трансферрин (соединяющийся с ионами железа) и церуплазмин (формирующий комплексы с медью).
Сигнальная функция белков
Огромное значение в протекании физиологических процессов в многоклеточных сложных организмах имеют белки-рецепторы. Они вмонтированы в плазматическую мембрану.
Служат они для восприятия и расшифровки различного рода сигналов, которые непрерывным потоком поступают в клетки не только от соседних тканей, но и из внешней среды.
В настоящее время, пожалуй, самым исследованным белком-рецептором является ацетилхолин. Он находится в ряде межнейронных контактов на мембране клетки.
Но сигнальная функция белков осуществляется не только внутри клеток. Многие гормоны связываются со специфическими рецепторами на их поверхности. Такое сформировавшееся соединение и является сигналом, который активирует физиологические процессы в клетках. Примером таких белков является инсулин, действующий в аденилатциклазной системе.
Защитная функция
Функции белков в клетке различны. Некоторые из них участвуют в иммунных ответах. Это защищает организм от инфекций.
Иммунная система способна отвечать на выявленные чужеродные агенты синтезом огромного количества лимфоцитов.
Эти вещества способны выборочно повреждать эти агенты, они могут быть чужеродными для организма, например бактерии, надмолекулярные частицы, или это могут быть раковые клетки.
Одна из групп — «бета»-лимфоциты — вырабатывает белки, которые попадают в русло крови. Они имеют очень интересную функцию. Эти белки должны распознавать чужеродные клетки и макромолекулы.Затем они соединяются с ними, формируя комплекс, который подлежит уничтожению. Белки эти называются иммуноглобулинами. Сами чужеродные компоненты – это антигены.
А иммуноглобулины, которые им соответствуют – антитела.
Структурная функция
В организме, помимо высокоспециализированных, существуют еще и структурные белки. Они необходимы, чтобы обеспечивать механическую прочность. Эти функции белков в клетке важны для поддержания формы и сохранения молодости организма.
Самым известным является коллаген. Это основной белок внеклеточного матрикса соединительных тканей. У высших млекопитающих он составляет до 1/4 общей массы белков.
Синтезируется коллаген в фибробластах, которые являются основными клеточками соединительных тканей.
Такие функции белков в клетке имеют огромное значение. Помимо коллагена, известен еще один структурный белок – эластин. Он также является составляющей внеклеточного матрикса.
Эластин способен наделять ткани возможностью растягиваться в определенных пределах и легко возвращаться в исходную форму. Еще один пример структурного белка – фиброин, который обнаружен у гусениц шелкопрядов.
Это основной компонент шелковых нитей.
Двигательные белки
Роль белков в клетке переоценить невозможно. Они принимают участие и в работе мышц. Мышечное сокращение является важным физиологическим процессом. В результате происходит превращение запасенного в виде макромолекул АТФ в химическую энергию. Непосредственными участниками процесса являются два белка – актин и миозин.
Эти двигательные белки представляют собой нитевидные молекулы, которые функционируют в сократительной системе скелетных мышц. Также они обнаруживаются в немышечных тканях у эукариотических клеток.
Еще один пример двигательных белков – тубулин. Из него построены микротрубочки, являющиеся важным элементом жгутиков и ресничек.Также микротрубочки, содержащие тубулин, обнаруживают в клетках нервной ткани животных.
Антибиотики
Огромна защитная роль белков в клетке. Частично ее возлагают на группу, которую принято называть антибиотиками.
Это вещества природного происхождения, которые синтезируются, как правило, в бактериях, микроскопических грибах и прочих микроорганизмах. Они нацелены на подавление физиологических процессов других конкурирующих организмов.
Открыты антибиотики белкового происхождения были в 40-х годах. Они произвели революцию в медицине, дав ей мощный толчок к развитию.
По своей химической природе антибиотики — весьма разнообразная группа. Они различаются и по механизму действия. Одни препятствуют синтезу белка внутри клеток, вторые блокируют выработку важных ферментов, третьи подавляют рост, четвертые — размножение.
Например, хорошо известный стрептомицин взаимодействуют с рибосомами бактериальных клеток. Таким образом, в них резко замедляется синтез белков. При этом данные антибиотики не взаимодействуют с эукариотическими рибосомами организма человека.
Это значит, что для высших млекопитающих данные вещества не токсичны.
Это далеко не все функции белков в клетке. Таблица антибиотических веществ позволяет определить и другие узкоспециализированные действия, которые эти специфические природные соединения способны оказывать на бактерии и не только.
В настоящее время ведутся изучения антибиотиков белкового происхождения, которые при взаимодействии с ДНК нарушают процессы, связанные с воплощением наследственной информации. Но пока такие вещества используют только при химиотерапии онкологических заболеваний.
Примером такого антибиотического вещества является дактиномицин, синтезируемый актиномицетами.
Токсины
Белки в клетке выполняют функцию весьма специфическую и даже неординарную. У ряда живых организмов вырабатываются ядовитые вещества – токсины. По своей природе это белки и сложные низкомолекулярные органические соединения. В качестве примера можно привести ядовитую мякоть гриба бледная поганка.
Запасные и пищевые белки
Некоторые белки выполняют функцию по обеспечению питанием зародышей животных и растений. Таких примеров много. Значение белка в клетке семян злаковых заключено именно в этом. Они будут питать формирующийся зачаток растения на первых стадиях его развития. У животных пищевыми белками являются яичный альбумин и молочный казеин.
Неизученные свойства белков
Приведенные выше примеры — лишь та часть, что уже достаточно изучена. Но в природе остается много загадок. Белки в клетке многих биологических видов уникальны, и в настоящее время даже классифицировать их затруднительно.
Например, монеллин — белок, обнаруженный и выделенный из африканского растения. На вкус он сладкий, но при этом не вызывает ожирения и не токсичен. В будущем это может быть превосходная замена сахару.
Еще один пример — белок, обнаруженный у некоторых арктических рыб, он препятствует замерзанию крови, действуя как антифриз в буквальном смысле этого сравнения.
У ряда насекомых в соединениях крыльев выявлен белок резилин, обладающий уникальной, практически идеальной эластичностью. И это далеко не все примеры веществ, которые только предстоит изучить и классифицировать.Источник: http://fb.ru/article/159150/znachenie-rol-i-funktsii-belkov-v-kletke-kakuyu-funktsiyu-v-kletke-vyipolnyayut-belki
2.3.3. Органические вещества клетки. Белки

Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга.
Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен.
Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы – ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
1.Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок.
Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
2.
Длинная молекула белка сворачивается и приобретает сначала вид спирали – вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие цепь.
3.
Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
4.
Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными.
Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Функции белков
Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении).
Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:1) структуры гена2) внешней среды3) их случайного сочетания
4) их строения
А2. Человек получает незаменимые аминокислоты путем1) их синтеза в клетках 3) приема лекарств2) поступления с пищей
4) приема витаминов
А3. При понижении температуры активность ферментов1) заметно повышается 2) заметно понижается3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует1) гемоглобин 2) коллаген 3) фибрин
4) миозин
А5. В каком из указанных процессов белки не участвуют?1) обмен веществ 2) кодирование наследственной информации3) ферментативный катализ
4) транспорт веществ
А6. Укажите пример пептидной связи:
Часть В
В1. Выберите функции, характерные для белков1) каталитическая 2) кроветворная 3) защитная 4) транспортная 5) рефлекторная
6) фотосинтетическая
В2.
Установите соответствие между структурой белковой молекулы и ее особенностями
| ОСОБЕННОСТИ СТРУКТУРЫ | СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ |
| А) имеет форму глобулыБ) удерживается пептидными связямиВ) удерживается пептидными, водородными, дисульфидными связямиГ) определяется последовательностью нуклеотидов в генеД) определяет биологическую активность белкаЕ) не спирализована | 1) первичная2) третичная |
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4.
Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их. 1) Большая часть химических реакций в организме катализируется ферментами. 2) Каждый фермент может катализировать множество типов реакций.
3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует. 4) Примером действия фермента может быть разложение мочевины уреазой. 5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком.
6) За одну секунду уреаза расщепляет до 30000 молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн. лет.
Источник: https://biology100.ru/index.php/materialy-dlya-podgotovki/kletka-kak-biologicheskaya-sistema/2-3-3-organicheskie-veshchestva-kletki-belki
Белки. Роль белков в организме человека
Белок (от греческого protos означает «первый», «наиважнейший») – это главный строительный материал нашего организма. Все ткани, органы и клетки человеческого организма имеют белковую природу.
Мышцы, волосы, ногти, кожа – это все БЕЛОК, поэтому роль белков в жизнедеятельности каждого из нас просто колоссальная.
И сегодня я хочу поговорить именно о роли белков в питании человека, как об одном из самых важных факторов крепкого здоровья и иммунитета.
Как устроен белок?
Молекула белка представляет собой спираль, которая состоит из аминокислотных остатков (аминокислот). Всего в природе насчитывают около 80 аминокислот, но для человеческого организма интересны всего 22 аминокислоты, из которых 12 – это заменимые аминокислоты и 10 – незаменимые. Так вот именно незаменимые аминокислоты представляет для нас наибольший интерес. Сейчас объясню почему.
Для человека очень важно, чтобы с пищей он потреблял все незаменимые аминокислоты, так как они не синтезируются в нашем организме самостоятельно! В этом и есть их главное отличие от заменимых аминокислот.
Если наш организм не получает хоть одну незаменимую аминокислоту, то это может стать причиной многих проблем со здоровьем, из-за чего роль белков в организме человека не стоит недооценивать.
В первую очередь нам интересны белки, которые по своему аминокислотному составу являются полноценными. Полноценные белки – это белки, в составе которых присутствуют все незаменимые аминокислоты. Если же в белке отсутствует хотя бы одна незаменимая аминокислота или она представлена в недостаточном количестве, то такой белок считается уже неполноценным.
Итак, какие же продукты представлены полноценным белком, а какие нет?
Полноценные белки – это в первую очередь белки животного происхождения: яйца, мясо животных, мясо рыбы, морепродукты, молочные продукты и соя (единственный растительный белок, который полностью полноценный).
Неполноценные белки – это белки растительного происхождения: орехи, бобовые, крупы и некоторые овощи.
Чтобы наш организм работал, как часы, а наша иммунная система была крепкой, нам нужно так выстроить свой суточный рацион питания, чтоб 60% всех потребляемых белков за день были ПОЛНОЦЕННЫМИ, а именно ЖИВОТНОГО происхождения!А теперь давайте рассмотрим основные функции белков в нашем организме.
Роль белков при похудении
Итак, ни для кого, я надеюсь, не секрет, что белковые продукты имеют относительно низкий гликемический индекс по сравнению с углеводными. Потребляя пищу, богатую белками, вы тем самым застраховываете себя от жиронакопления и набора лишнего веса, минуя резкий подъем сахара в крови и выброса большого количества инсулина.
Также белковые продукты разгоняют обмен веществ в состоянии покоя, поддерживая и питая вашу мышечную массу, а это приводит к большему потреблению калорий вашим организмом в целом.
То есть, простыми словами, регулярно потребляя такие продукты как: мясо животных, рыбу, молочные продукты, яйца и другие источники полноценного белка, – вы расходуете больше калорий, чем ваша подруга Маша, которая питается тортиками и булочками.
Еще белковые продукты требуют больше времени на переваривание в отличие от углеводов, что помогает долгое время не ощущать чувство голода и оставаться сытыми, а это в свою очередь спасает от переедания и частых вредных перекусов в течение дня.
Белковые продукты зачастую имеют среднюю либо низкую калорийность. Если вы в процессе похудения, то выбирайте мяса нежирных сортов птицы и животных: индейка, курица, постная говядина, телятина, кролик.
Это поможет вам всегда быть в форме, при этом получая все незаменимые аминокислоты и витамины, содержащиеся в этих продуктах.
Также отдавайте предпочтение маложирным молочным продуктам: творог 0-5% жирности, сметана до 15% жирности, сыр до 25%, молоко и кефир до 2,5%.
Нормы белка
В разных источниках норма потребления белка всегда разная, мнения на этот счет разделились. Одна группа считает, что нужно потреблять 1 г белка на 1 кг веса тела, не больше и не меньше; другая группа думает, что человеку нужно не менее 1,5 г белка на 1 кг веса тела; третья группа — 2 г и четвертая — 2,5- 3 г.
Лично мое мнение таково:
1. Если вы обычный человек, не занимающийся никаким видом спорта и ведущий, по большему счету, малоподвижный образ жизни, то ваша суточная норма белка — от 1 до 1,2 г на 1 кг веса тела.
2. Если же вы ведете активный образ жизни: занимаетесь танцами, посещаете фитнес клуб 3-5 раз в неделю, играете в волейбол/футбол/теннис и т.д. при этом еще и работаете, то ваша суточная норма белка должна составлять 1,5-2,5 г на 1 кг вашего веса.
3. И последний вариант: если ваша работа связана с тяжелым физическим трудом, вы профессионально занимаетесь спортом или вы готовитесь к соревнованиям, то ваша норма по белку может быть более 2,5 г, но этот момент нужно оговаривать с вашим тренером или наставником.
Давайте теперь рассмотрим, что же ожидает человека, если в его организм поступает недостаточное количество белка.
Низкое потребление белка и последствия
При нехватке белка:
- Процессы старения идут в два раза быстрее.
- Организм начинает синтезировать белок, расщепляя собственные мышцы и ткани органов, в первую очередь страдает сердце.
- Замедляется обмен веществ из-за потери мышечной массы, и начинает увеличиваться жировая масса тела.
- Страдает иммунная функция: организм слабеет и становится уязвим к различным заболеваниям.
- Понижается кровяное давление, так как стенки сосудов растягиваются.
- Развивается малокровие, а как следствие этого появляется синдром хронической усталости.
- Нарушается работа желудочно-кишечного тракта, так как стенки органов пищеварения становятся вялыми.
- Нарушаются функции печени, поджелудочной железы, увеличивается риск развития ишемической болезни сердца.
Как вы видите роль белков в организме человека достаточно велико. Эти доводы дают веские основания полагать, что белки должны составлять как минимум 40% вашего рациона питания, а если вы регулярно тренируетесь или занимаетесь каким-либо видом спорта, то эта цифра автоматически увеличивается до 50% .
Я надеюсь, что данная статья была для вас полезной. Теперь вы знаете, что недооценивать роль белков в питании не стоит. И если вы до этого потребляли мало белковых продуктов и не понимали, почему у вас нет результатов от занятий в тренажерном зале или выпадают волосы, то сейчас у вас появился хороший шанс пересмотреть ваш рацион питания и устранить изъяны.
С вами была искренне Ваша, Скрипник Янелия!
Источник: http://fitnessomaniya.ru/belki-rol-belkov-v-organizme-cheloveka/
Белки, их строение и функции

|
Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом. Ф.Энгельс Цели. Расширить знания о белках как природных полимерах, о многообразии их функций во взаимосвязи со строением и свойствами; использовать опыты с белками для реализации межпредметных связей и для развития интереса учащихся. План изучения
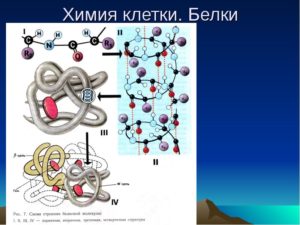
ХОД УРОКА Роль белков в организмеУчитель биологии. Из органических веществ, входящих в живую клетку, важнейшую роль играют белки. На их долю приходится около 50% массы клетки. Благодаря белкам организм приобрел возможность двигаться, размножаться, расти, усваивать пищу, реагировать на внешние воздействия и т. д. «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка», – писал Энгельс в своих трудах. Состав, строение, свойства белковУчитель химии. Белки – это сложные высокомолекулярные природные соединения, построенные из -аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков. Число аминокислотных остатков, входящих в молекулы, различно: инсулин – 51, миоглобин – 140. Отсюда Mr белка от 10 000 до нескольких миллионов. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским. Эта теория получила подтверждение в последующих работах. Согласно полипептидной теории белки имеют определенную структуру. Первичная структура белка – последовательность чередования аминокислотных остатков (все связи ковалентные, прочные) (рис. 1). Вторичная структура – форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль (за счет множества водородных связей) (рис. 2). Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи) (рис. 3). Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс (рис. 4). Химические свойства белковПри нагревании белков и пептидов с растворами кислот, щелочей или при действии ферментов протекает гидролиз. Гидролиз белков сводится к расщеплению полипептидных связей: Лабораторный опыт 1.
|
Лабораторный опыт 2.
Цветные качественные реакции белков
а) Биуретовая реакция; б) ксантопротеиновая реакция;
в) взаимодействие белка с ацетатом свинца при нагревании.
Учительхимии. Данные опыта 1 показывают, что загрязнение природной среды солями тяжелых металлов приводит к отрицательным последствиям для живых организмов.
Природные белки теряют присущие им специфические свойства, становятся нерастворимыми, денатурируют. При отравлении людей солями тяжелых металлов используют молоко, белки которого связывают ионы таких металлов.
(Демонстрация фрагмента из 1-й части фильма «Белки, строение белковых молекул».)
Функции белков
Учитель биологии. Функции белков разнообразны.
1. Строительный материал – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Из белков построены кровеносные сосуды, сухожилия, волосы.
2.
Каталитическая роль – все клеточные катализаторы – белки (активные центры фермента). Структура активного центра фермента и структура субстрата точно соответствуют друг другу, как ключ и замок.
3.
Двигательная функция – сократительные белки вызывают всякое движение.
4. Транспортная функция – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
5.
Защитная роль – выработка белковых тел и антител для обезвреживания чужеродных веществ.
6. Энергетическая функция – 1 г белка эквивалентен 17,6 кДж.
белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень – 57%, мозг – 15%, жировая ткань, костная и ткань зубов – 14–28%.
Белки – необходимые компоненты пищевых продуктов, они входят в состав лекарственных препаратов.
Синтез белков
Учитель биологии. Человек в течение длительного времени потреблял белки, выделенные главным образом из растений и животных. В последние десятилетия ведутся работы по искусственному получению белковых веществ.
Половина земного шара находится в состоянии белкового голодания, а мировая нехватка пищевого белка составляет около 15 млн т в год при норме потребления белка в сутки взрослым человеком 115 г.
(Демонстрация фрагмента 2-й части кинофильма «Белки, строение белковых молекул» – о сборке молекулы белка.)
Превращения белков в организме
Учительхимии. Выводы. Все белки являются полипептидами, но не всякий полипептид является белком. Каждый белок имеет свое специфическое строение.
Домашнее задание. Рудзитис Г.Е., Фельдман Ф.Г. Химия-11. М.: Просвещение, 1992, с. 18–22.
ЛИТЕРАТУРА
Макареня А.А. Повторим химию. М.: Высшая школа, 1989; Пособие по химии. Органическая химия для подготовки в учебные заведения медико-биологического профиля. Ростов-на-Дону: Изд-во Ростовского ун-та, 1995;
Колтун М. Мир химии. М.: Детская литература, 1988;
Книга для чтения по органической химии. Сост. П.Ф.Буцкус. М.: Просвещение, 1985;
Чертков И.Н. Эксперимент по полимерам в средней школе. М.: Просвещение, 1971;
Кузовая Т.В., Калякина Е.А. Белки. «Химия» (Издательский дом «Первое сентября»), 2003, № 3, с. 14;
Беляев Д.К., Воронцов Н.Н., Дымишц Г.М. и др. Общая биология. М.: Просвещение, 1999, 287 с.
С.Д.ЧЕРВОННАЯ, учитель-методист средней школы № 5
(г. Моздок, Республика Северная Осетия– Алания)
Источник: https://him.1sept.ru/2003/46/22.htm