Электронное и пространственное строение, номенклатура, гомология и изомерия алкенов (10 класс)
12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева
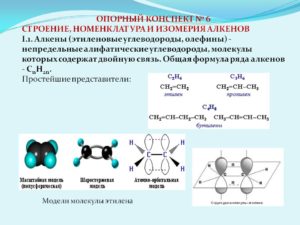
Алке́ны (олефины, этиленовыеуглеводороды) —ациклические непредельные углеводороды,содержащие одну двойнуюсвязьмеждуатомами углерода,образующие гомологический ряд с общейформулой CnH2n
Гомологическийряд.
| этен (этилен) | C2H4 |
| пропен | C3H6 |
| бутен | C4H8 |
| пентен | C5H10 |
| гексен | C6H12 |
| гептен | C7H14 |
| октен | C8H16 |
| нонен | C9H18 |
| децен | C10H2 |
Простейшималкеном является этилен (C2H4).По номенклатуре IUPACназвания алкенов образуются от названийсоответствующих алканов заменойсуффикса «-ан» на «-ен»; положение двойнойсвязи указывается арабской цифрой.
Углеводородныерадикалы, образованные от алкенов имеютсуффикс «-енил».Тривиальныеназвания: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Атомыуглерода при двойной связи находятсяв состоянии sp²гибридизации,и имеют валентныйугол 120°.
Дляалкенов характерны изомерия углеродногоскелета, положения двойной связи,межклассовая и пространственная.Физическиесвойства
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гексадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Дегидрирование алканов
Этоодин из промышленных способов полученияалкенов
Гидрирование алкинов
Частичноегидрирование алкинов требуетспециальных условий и наличие катализатора
Двойнаясвязь является сочетания сигма- ипи-связей. Сигма- связь возникает приосевом перекрывании sp2– орбиталей, а пи-связь при боковомперекрывании
ПравилоЗайцева:
Отщеплениеатома водорода в реакциях элиминированияпроисходит преимущественно от наименеегидрогенизированного атома углерода.
13.Алкены. Строение. sp2гибридизация, параметры кратной связи.Реакции электрофильного присоединениягалогенов, галогеноводородов, ,хлорноватистой кислоты. Гидратацияалкенов. Правило Морковникова. Механизмыреакций.
Алке́ны (олефины, этиленовыеуглеводороды) —ациклические непредельные углеводороды,содержащие одну двойнуюсвязьмеждуатомами углерода,образующие гомологический ряд с общейформулой CnH2n
Однаs-и 2 p-орбиталисмешиваются и образуются 2 равноценныеsp2-гибридныеорбитали, расположенные в одной плоскостипод углом 120.
Еслисвязь образуется более чем одной паройэлектронов, то она называется кратной.
Кратнаясвязь образуется в тех случаях, когдаимеется слишком мало электронов исвязывающихся атомов, чтобы каждаяпригодная для образования связи валентнаяорбиталь центрального атома моглаперекрыться с какой-либо орбитальюокружающего атома.
Реакции электрофильного присоединения
Вданных реакциях атакующейчастицей является электрофил.
Галогенирование:
Гидрогалогенирование
Электрофильноеприсоединение галогенводородовк алкенам происходит по правилуМарковникова
Марковниковаправило:при присоединении протонных кислотили воды кнесимметричным алкенам или алкинаматом водородаприсоединяется к наиболее гидрогенизированномуатому углерода
гидрогенизированныйатом углерода – тот атом, к которомуприсоединен водород. Наиболеегидрогенизированный – там где большевсего Н
- Присоединение хлорноватистой кислоты с образованием хлоргидринов:
Гидратация
Реакцияприсоединения воды калкенам протекает в присутствии сернойкислоты[21]:
Карбкатион —частица, в которой на атоме углеродасосредоточен положительный заряд, атомуглерода имеет вакантную p-орбиталь.
14.Этиленовые углеводороды. Химическиесвойства: реакции с окислителями.Каталитическое окисление, реакция снадкислотами, реакция окисления догликолей, с разрывом связи углерод-углерод,озонирование. Вакер-процесс. Реакциизамещения.
Алке́ны (олефины, этиленовыеуглеводороды) —ациклические непредельные углеводороды,содержащие одну двойнуюсвязьмеждуатомами углерода,образующие гомологический ряд с общейформулой CnH2n
Окисление
Окислениеалкенов может происходить в зависимостиот условий и видов окислительныхреагентов как с разрывом двойной связи,так и с сохранением углеродного скелета.
Присжигании на воздухе олефины даютуглекислый газ и воду.
H2C=CH2 +3O2 => 2CO2 +2H2O
CnH2n+3n/O2 => nCO2 +nH2O– общая формула
Каталитическоеокисление
Вприсутствии солей палладия этилен окисляетсядо ацетальдегида.Аналогичнообразуется ацетон из пропена.
- При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
(кетон)
Приокислении алкенов разбавленным раствороммарганцовки образуются двухатомныеспирты – гликоли (реакция Е.Е.Вагнера).Реакция протекает на холоде.
| 3H2C=CH2 + 2KMnO4 + 4H2O ® 3 | CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH I IOH OH |
Ациклическиеи циклические алкены при взаимодействиис надкислотами RCOOOH в неполярной, средеобразуют эпоксиды (оксираны), поэтомусама реакция носит название реакцииэпоксидирования.
Озонированиеалкенов.
привзаимодействии алкенов с озономобразуются перекисные соединения,которые называются озо-нидами. Реакцияалкенов с озоном является наиболееважным методом окислительного расщепленияалкенов по двойной связи
Алкеныне вступают в реакции замещения.
Вакер-процесс —процессполучения ацетальдегида прямымокислением этилена.
Вакер-процессоснован на реакции окисления этиленадихлоридом палладия:
CH2=CH2 +PdCl2 +H2O= CH3CHO+ Pd + 2HCl
15.Алкены: химические свойства. Гидрирование.Правило Лебедева. Изомеризация иолигомеризация алкенов. Радикальная иионная полимеризация. Понятие полимер,олигомер, мономер, элементарное звено,степень полимеризации. Теломеризацияи сополимеризация.
Гидрирование
Гидрирование алкеновнепосредственно водородом происходиттолько в присутствии катализатора.Катализаторами гидрированияслужат платина,палладий, никель
Гидрированиеможно проводить и в жидкой фазе сгомогенными катализаторами
Реакцииизомеризации
Принагревании возможна изомеризациямолекул алкенов, которая
можетпривести как к перемещению двойнойсвязи, так и к изменению скелета
углеводорода.
CH2=CH-CH2-CH3 CH3-CH=CH-CH3
Реакцииполимеризации
Эторазновидность реакции присоединения.Полимеризация — это реакция последовательногосоединения одинаковых молекул в большиепо размеру молекулы, без выделениякакого-либо низкомолекулярного продукта.При полимеризации атом водородаприсоединяется к наиболее гидрогенизированномуатому углерода, находящемуся у двойнойсвязи, а к другому атому углеродаприсоединяется остальная часть молекулы.CH2=CH2+ CH2=CH2 + … -CH2-CH2-CH2-CH2- …
илиn CH2=CH2 (-CH2-CH2-)n (полиэтилен)
Вещество,молекулы которого вступают в реакциюполимеризации, называются мономером.Молекула мономера обязательно должнаиметь хотя бы одну двойную связь.
Образующиеся полимеры состоят избольшого количества повторяющихсяцепочек, имеющих одинаковое строение(элементарныхзвеньев).
Число, показывающее, сколько раз вполимере повторяется структурное(элементарное) звено, называется степеньюполимеризации(n).
Взависимости от вида промежуточныхчастиц, образующихся при полимеризации,различают 3 механизма полимеризации:а) радикальный; б)катионный; в) анионный.
Попервому методу получают полиэтилен высокогодавления:
Катализаторомреакции выступают пероксиды.
Второйи третий методы предполагает использованиев качестве катализаторов кислот(катионная полимеризация), металлорганическихсоединений.
Вхимии олигомер ) —молекула в виде цепочки изнебольшого числаодинаковых составныхзвеньев.
Теломеризация
Теломеризация– олигомеризация алкенов в присутствиивеществ – передатчиков цепи (телогенов).В результате реакции образуется смесьолигомеров (теломеров), концевые группыкоторых представляют собой частителогена. Например, в реакции CCl4 сэтиленом телогеном является CCl4.
CCl4 +nCH2=CH2 => Cl(CH2CH2)nCCl3
Инициированиеэтих реакций может осуществлятьсярадикальными инициаторами или g -излучением.
16.Алкены. Реакции радикального присоединениягалогенов и галогеноводородов (механизм).Присоединение карбенов к олефинам.Этилен, пропилен, бутилены. Промышленныеисточники и основные пути использования.
Алкенылегко присоединяют галогены, особеннохлор и бром (галогенирование).
Типичнойреакцией такого типа являетсяобесцвечивание бромной воды
CH2=CH2+ Вr2 → СH2Br-CH2Br (1,2-дибромэтан)
Электрофильноеприсоединение галогенводородовк алкенам происходит по правилуМарковникова:Марковниковаправило:при присоединении протонных кислотили воды кнесимметричным алкенам или алкинаматом водородаприсоединяется к наиболее гидрогенизированномуатому углерода
гидрогенизированныйатом углерода – тот атом, к которомуприсоединен водород. Наиболеегидрогенизированный – там где большевсего Н
Реакцииприсоединения карбенов
Карбены CR2: —высокореакционные короткоживущиечастицы, которые способны легкоприсоединяться к двойной связиалкенов[33].В результате реакции присоединениякарбена образуются производные циклопропана
Этиле́н — органическое химическоеописываемоеформулой С2H4.Является простейшималкеном (олефином)соединение.При нормальных условиях — бесцветныйгорючий газ со слабым запахом. Частичнорастворим в воде.
Содержит двойную связьи поэтому относится к ненасыщенным илинепредельным углеводородам.Играет чрезвычайно важную роль впромышленности.
Этилен —самое производимое органическоесоединение в мире: Окисьэтилена ;полиэтилен,уксусная кислота, этиловый спирт.
Основныехимические свойства( не учи, просто пусть будут на всякийслучай, вдруг списать получится)
Этилен —химически активное вещество. Так как вмолекуле между атомами углерода имеетсядвойная связь, то одна из них, менеепрочная, легко разрывается, и по местуразрыва связи происходит присоединение,окисление, полимеризация молекул.
CH2=CH2 +Br2 →CH2Br—CH2Br
Происходитобесцвечивание бромной воды. Этокачественная реакция на непредельныесоединения.
CH2=CH2 +H — H → CH3 —CH3 (поддействием Ni)
CH2=CH2 +HBr → CH3 —CH2Br
CH2=CH2 +HOH → CH3CH2OH(под действием катализатора)
Этуреакцию открыл A.M.Бутлеров,и она используется для промышленногополучения этилового спирта.
Этиленлегко окисляется. Если этилен пропускатьчерез раствор перманганата калия, тоон обесцветится. Эта реакция используетсядля отличия предельных и непредельныхсоединений. Окись этилена — непрочноевещество, кислородный мостик разрываетсяи присоединяется вода, в результатеобразуетсяэтиленгликоль.Уравнение реакции[6]:3CH2=CH2 +2KMnO4 +4H2O→ 3HOH2C— CH2OH+ 2MnO2 +2KOH
C2H4 +3O2 →2CO2 +2H2O
- Полимеризация (получение полиэтилена):
nCH2=CH2 →(-CH2-CH2-)n
Пропиле́н (пропен)СН2=СН-СН3 — непредельный(ненасыщенный) углеводород рядаэтилена, горючий газ. Пропиленпредставляет собой газообразное веществос низкой температурой кипения tкип=−47,6 °C
Обычнопропилен выделяют из газов нефтепереработки(при крекинге сыройнефти, пиролизе бензиновых фракций) илипопутных газов, а также из газов коксованияугля.
Источник: https://StudFiles.net/preview/4521044/page:6/
Алкены — номенклатура, получение, характерные химические свойства

К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены).
Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома).
Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации.
Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь.
Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к.
она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Строение этилена
Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения.
Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Источник: http://himege.ru/alkeny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/
Алкены. Строение, номенклатура, изомерия и физические свойства (химия 10 класс)
На уроке вы начнете изучать новый гомологический ряд углеводородов, который относится уже к непредельным углеводородам. Тема: «Алкены. Строение, номенклатура, изомерия и физические свойства». Вы узнаете о том, что представляют собой алкены: строение алкенов и их физические свойства, а также изомерия и номенклатура.
Тема: Непредельные углеводороды
Урок: Алкены. Строение, номенклатура, изомерия и физические свойства
1. Понятие о алкенах и их классификация
Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4:
2. Номенклатура алкенов
Двойную связь обозначают с помощью суффикса —ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
CH3-CH2-CH2-CH=CH-CH3
гексен-2 (гексен-4)
2-этилпентен-1
3. Строение алкенов
Рис. 1. Строение этилена
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о. Рис. 1.
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью. Рис. 2. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. Рис. 3.
В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
Рис. 2. Модель молекулы этена
Рис. 3. Модель молекулы пропена
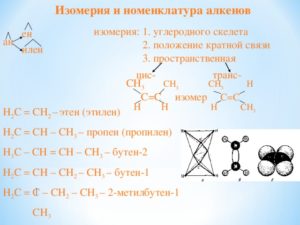
4. Изомерия алкенов
1. Изомерия углеродного скелета.
бутен-1 2-метилпропен
2. Изомерия положения двойной связи.
бутен-1 бутен-2
3. Межклассовая изомерия (с циклоалканами)
циклобутан метилциклопропан
4. Геометрическая изомерия.
Рис. 4. Геометрические изомеры бутена-2
Вращения вокруг двойной связи не происходит, ведь для этого нужно разорвать π-связь. Из-за этого у алкенов существует изомерия, связанная с тем, что заместители могут располагаться по одну или по разные стороны двойной связи, как, например, у бутена-2. Рис. 4.
Для бутена-1 геометрическая изомерия невозможна (у одного из атомов С при двойной связи оба заместителя одинаковы: 2 атома водорода).
5. Физические свойства и нахождение в природе алкенов
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.
Алкены в природе
Этилен образуется в фруктах, регулируя процесс их созревания. К классу алкенов принадлежат феромоны некоторых насекомых.
Подведение итога урока
На уроке вы начали изучать новый гомологический ряд углеводородов, который относится уже к непредельным углеводородам. Тема: «Алкены. Строение, номенклатура, изомерия и физические свойства». Вы узнали о том, что представляют собой алкены: строение алкенов и их физические свойства, а также изомерия и номенклатура.
Список литературы
1. Рудзитис Г. Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok. ru .
2. Органическая химия .
3. Химик .
4. Варсон .
Домашнее задание
1. №№ 1, 3 (с. 39) Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.2. Какой вид изомерии наблюдается у непредельных углеводородов, а у предельных такой изомерии нет?
3. Для каких целей используют этилен?
Закрепите материал с помощью тренажёров
- Тренажёр 1 Тренажёр 2 Тренажёр 3
Источник: http://dp-adilet.kz/alkeny-stroenie-nomenklatura-izomeriya-i-fizicheskie-svojstva-ximiya-10-klass/
Виды изомерии алкенов: общая формула, гомологический ряд, структурная, межклассовая и пространственная
Алкеновые углеводороды (олефины) являются одним из классов органических веществ, которым присущи свои химические и физические свойства. Виды изомерии алкенов у представителей данного класса не повторяются с изомерией других органических веществ.
Характерные признаки класса
Этиленовыми олефинами именуютодин из классов непредельных углеводородов, содержащих одну двойную связь.
По физическим свойствам представители данной категории непредельных соединений являются:
- газами,
- жидкостями,
- твердыми соединениями.
В составе молекул присутствует не только «сигма»-связь, но и «пи»-связь. Причиной этому является наличие в структурной формуле гибридизации «sp2», которой свойственно расположение атомов соединения в одной плоскости.
При этом между ними формируется угол не менее ста двадцати градусов. Негибридизованным орбиталям «р» свойственно расположение как поверх молекулярной плоскости, так и под ней.
Такая особенность строения приводит к формированию дополнительных связей – «пи» или «π».
Описанная связь менее прочна по сравнению с «сигма»-связями, так как перекрывание боком имеет слабое сцепление.
Для суммарного распределения электронных плотностей образующихся связей характерна неоднородность. При вращении возле углерод-углеродной связи происходит нарушение перекрывания «р»-орбиталей.
Для каждого алкена (олефина) такая закономерность является отличительным признаком.
Практически всем этиленовым соединениям присущи высокие температуры кипения и плавления, характерные не для всех органических веществ. Представители указанного класса непредельных углеводов быстро растворяются в воде и других растворителях органического состава.
Внимание! Ациклические непредельные соединения этиленовые углеводороды имеют общую формулу — CnH2n.
Гомология
Исходя из того, что общая формула алкенов CnH2n, им присуща определенная гомология. Гомологический ряд алкенов начинает первый представитель этилен или этен.
Данное вещество в обычных условиях является газом и содержит два атома углерода и четыре атома водорода – C2H4. За этеном гомологический ряд алкенов продолжает пропен и бутен. Их формулы следующие: «C3H6» и «C4H8».
При обычных условиях они также являются газами, которые тяжелее воздуха, а значит, собирать их необходимо пробиркой, перевернутой вниз дном.
Общая формула алкенов позволяет рассчитать следующего представителя данного класса, имеющего не менее пяти атомов углерода в структурной цепи. Это пентен с формулой «C5H10».
По физическим характеристикам указанное вещество относится к жидкостям, так же как двенадцать следующих соединений гомологической линии.
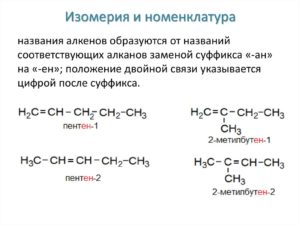
Среди алкенов с указанными характеристиками есть и твердые вещества, которые начинаются с формулы C18H36. Жидким и твердым этиленовым углеводородам не свойственно растворение в воде, но при попадании в органические растворители они вступают с ними в реакцию.Описанная общая формула алкенов подразумевает замену ранее стоявшего суффикса «ан» на «ен». Это закреплено правилами ИЮПАК. Какого бы представителя данной категории соединений мы не взяли, у них всех есть описанный суффикс.
В названии этиленовых соединений всегда присутствует определенная цифра, которая указывает на местоположение двойной связи в формуле. Примерами этого служит: «бутен-1» или «пентен-2». Атомную нумерацию начинают с того края, к которому ближе находится двойная конфигурация. Это правило является «железным» во всех случаях.
Изомерия
В зависимости от имеющегося вида гибридизации алкенов им присущи некоторые типы изомерии, каждый из которых имеет свои особенности и строение. Рассмотрим основные виды изомерии алкенов.
Структурного типа
Структурная изомерия подразделяется на изомеры по:
- углеродному скелету;
- расположению двойной связи.
Структурные изомеры углеродного скелета возникают в случае появления радикалов (ответвлений от главной цепи).
Изомерами алкенов указанной изомерии будут:
Бутен-1:
CH2=CH—CH2—CH3.
2-метилпропен-1:
CH2=C—CH3
│
CH3.
У представленных соединений общее количество углеродных и водородных атомов (C4H8), но разное строение углеводородного скелета. Это структурные изомеры, хотя свойства их не одинаковы. Бутену-1 (бутилену) присущ характерный запах и наркотические свойства, раздражающие дыхательные пути. Данными особенностями не обладает 2-метилпропен-1.
В данном случае нет изомеров у этилена (C2H4), так как он состоит только из двух углеродных атомов, куда нельзя подставить радикалы.
Совет! Радикал разрешается ставить к средним и предпоследним углеродным атомам, но не разрешается располагать их около крайних заместителей. Данное правило работает для всех непредельных углеводородов.
Относительно расположения двойной связи различают изомеры:
Пентен-1:
CH2=CH—CH2—CH2-CH3.
Пентен-2:
CH3-СH=CH—CH2-CH3.
Общая формула алкенов у представленных примеров: C5H10,, но местоположение одной двойной связи различное. Свойства указанных соединений будут различаться. Это структурная изомерия.
Пространственного типа
Пространственная изомерия алкенов связана с характером расположения углеводородных заместителей.
На основании этого различают изомеры:
Общая формула алкенов позволяет создавать «транс-изомеры» и «цис-изомеры» у одного и того же соединения. Возьмем, к примеру, бутилен (бутен). Для него можно создать изомеры пространственного строения, по-разному расположив относительно двойной связи заместителей. С примерами изомерия алкенов будет выглядеть так:
«цис-изомер» «транс-изомер»
Бутен-2 Бутен-2
Из указанного примера видно, что у «цис-изомеров» по одну сторону плоскости расположения двойной связи находятся два одинаковых радикала.
Для «транс-изомеров» это правило не работает, так как у них относительно углеродной цепи «С=С» располагаются два не похожих заместителя.
Учитывая данную закономерность, можно самим строить «цис» и «транс» изомеры для различных ациклических этиленовых углеводородов.
Представленные «цис-изомер» и «транс-изомер» для бутена-2 невозможно превратить один в другой, так как для этого необходимо вращение вокруг имеющейся углеродной двойной цепочки (С=С). Чтобы осуществить данное вращение необходимо определенное количество энергии, чтобы разорвать существующую «p-связь».
На основании всего вышеизложенного можно сделать вывод, что изомеры «транс» и «цис» вида являются индивидуальными соединениями с определенным набором химических и физических свойств.
Нет изомеров у какого алкена. Пространственных изомеров не имеет этилен из-за одинакового расположения водородных заместителей относительно двойной цепи.
Межклассовые
Межклассовая изомерия у алкеновых углеводородов распространена значительно. Причиной этому служит сходность общей формулы представителей данного класса с формулой циклопарафинов (циклоалканов). У данных категорий веществ в формулах одинаковое количество углеродных и водородных атомов, кратное составу (CnH2n).
Межклассовые изомеры будут выглядеть так:
Пропен-1:
CH2=CH—CH3.
Циклопропан:
CH2
∕ \
CH2―CH2.
Выходит, что формуле C3H6 отвечают два соединения: пропен-1 и циклопропан. Из структурного строения видно разное расположение углерода относительно друг друга. По свойствам указанные соединения также разные.
Пропен-1 (пропилен) – это газообразное соединение с низкой температурой кипения. Для циклопропана характерно газообразное состояние с резким запахом и едким вкусом. Химические свойства данных веществ также различаются, но состав у них идентичен.
В органический химии данный вид изомеров именуют межклассовым.
Алкены. Изомерия алкенов. ЕГЭ. Органическая химия.
Алкены: Строение, номенклатура, изомерия
Вывод
Алкеновая изомерия – это их важная характеристика, благодаря которой в природе появляются новые соединения с другими свойствами, которые находят применение в промышленности и быту.
Источник: https://uchim.guru/himiya/vidy-izomerii-alkenov.html

