Урок по химии для 9 класса Щелочные металлы
Конспект урока по Химии
Наша кнопка
Скачать материал
Урок химии в 9 классе
Щелочные металлы.
Цели урока: Дать общую характеристику ЩМ. Рассмотреть их атомное строение, основные физические, химические свойства, важнейшие соединения ЩМ и их применение.
Оборудование: ЩМ (Li, Na, К), растворы кислот, фенолфталеин, стеклянная посуда (колбы, чашки Петри), нихромовая проволока с ушком для прокаливания веществ в пламени газовой горелки.
Ход урока
I. Организационный момент. Проверка домашнего задания
- Даны сплавы мельхиор (Сu + Ni + Fe + Мn) и нихром (Ni, Cr, Al) (на доске)В случае обработки сплавов раствором НС1, какой из сплавов полностью перейдет в раствор?
- В каком случае А1 лучше защищен от коррозии, при покрытии его: a) Mg б) Сг?
- В каком случае Fe лучше защищено от коррозии, при покрытии его: а) Сu; б) Сг?
Ответы: 1) нихром; 2) Mg; 3) Сг
П. Общая характеристика щелочных металлов
1. Охарактеризуйте положение ЩМ в ПСХЭ (главная подгруппа I группы), к ним относятся: Li,Na, K, Rb, Cs,
2. Электронные формулы их атомов: +4Li 2e; le; +!1Na 2e; 8e; le; +]9K 2e; 8е; 8е; 1е.
Fr — радиоактивный металл, наиболее долгоживущий изотоп его имеет период полураспада 22 минуты.
— Что общего в атомном строении ЩМ?
• Общим является одинаковое строение внешнего электронного слоя, у всех ЩМ на последнем уровне находится 1 электрон. Следовательно ЩМ проявляют в соединениях постоянную с.о. +1. ЩМ являются очень сильными восстановителями.
В подгруппе от лития к цезию радиусы атомов увеличиваются, т.к. возрастает число электронных слоев. Поэтому увеличиваются и восстановительные способности ЩМ от лития к цезию.
Вывод: ЩМ должны обладать типичными свойствами металлов: металлическим блеском; тепло и электропроводностью, пластичностью.
Демонстрация: образцы ЩМ., хранятся металлы как «кащеева смерть»: в металлическом сейфе, в металлической банке с асбестовой крошкой, в которой находится стеклянная банка с металлом. Все ЩМ под слоем керосина, а литий — в вазелине. Объясните это разницей в значениях плотностей металлов:
Li
Na
К
Rb
Cs
Fr
— Исходя из электронного строения атомов, охарактеризуйте химические свойства ЩМ.
• ЩМ являются очень сильными восстановителями, т. к. обладают большим атомным радиусом и содержат только 1 электрон на внешнем энергетическом уровне, который легко отдают при взаимодействии с другими соединениями.
— Как изменяются химические свойства ЩМ в подгруппе при увеличении поряд-кового номера элемента? (усиливаются) Почему?
• С увеличением № ЩМ увеличивается атомный радиус элементов, увеличивается число атомных слоев, следовательно, легкость отдачи электронов возрастает. Поэтому, восстановительные свойства ЩМ в подгруппе сверху вниз увеличиваются. Самый сильный восстановитель в ПСХЭ — Fr.
М0 – 1ё ↔ М+
атом ион
III. Химические свойства щелочных металлов
Продемонстрируйте классу свежий блестящий срез ЩМ, быстро тускнеющий на свету. Объясняется это явление чрезвычайно высокой химической активностью этих металлов, поэтому на воздухе ЩМ покрыты пленкой сложного состава.
? Зная химические свойства ЩМ, предположите, какие соединения могут входить в состав этой пленки: в пленке присутствуют оксиды, пероксиды, гидроксиды (влага воздуха), в случае лития еще и нитриды. Отметьте отличия лития от остальных ЩМ:
I. Общие свойства:
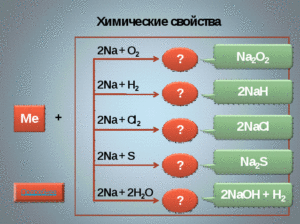
1. С окислителями (простыми веществами) – галогенами, серой, фосфором, образуя соли:
0 0 +1-1
2М + Г2 = 2МГ (галогениды)
0 0 +1 -2
2М + S = M2S (сульфиды) Демонстрация
0 0 +1 -3
3М + Р = М3Р (фосфиды)
2. С кислородом калий и натрий образуют пероксиды (Пероксиды — это оксиды, в которых осуществляется связь между двумя атомами кислорода: Na—О—О—Na.)
0 0 +1 -1
2М + О2 = М2О2
Литий образует нормальный оксид при сгорании на воздухе (остальные ЩМ образуют пероксиды);
0 0 +1 -2
4Li + O2 = 2Li2O
3. С азотом литий взаимодействует при комнатной температуре, а остальные ЩМ – при нагревании:
0 0 +1 -3
6Li + N2(влажн.) = 2Li3N (комн. темп.)
Отметьте, что в присутствии влаги литий реагирует при комнатной температуре с азотом воздуха. Забегая вперед, скажите, что азот воздуха химически очень пассивен и взаимодействует при обычных условиях только с литием.
2) некоторые соли лития плохо растворимы в воде (Li3PO4, Li2CO3, LiF).
II. Со сложными веществами:
2М + 2Н2О = 2МОН + Н2↑ Демонстрация
2Li + 2H2O = 2LiOH + H2↑
Li2O + H2O = 2LiOH
При этом, образуются соответствующие щелочи и выделяется водород. Разница проявляется в химической активности металлов. Литий реагирует спокойно, без пламени. Все последующие за ним элементы-аналоги реагируют с водой с воспламенением и взрывом, который усиливается от Na к Cs. Ребята отмечают изменение окраски воды с бесцветной на ярко-малиновую.
— С чем связано изменение окраски индикатора?
• При взаимодействии ЩМ с водой образуются щелочи, которые и окрашивают индика-тор в малиновый цвет.
https://www.youtube.com/watch?v=7JLRODnRwb4
ЩМ взаимодействуют с:
-
С кислотами (хотя уравнения реакций обычно не пишут, т. к. ЩМ реагируют как с молеку-лами кислоты, так и с молекулами воды)
IV. Важнейшие соединения ЩМ
— Как вы считаете, ребята, в каком виде существуют в природе ЩМ — в самородном состоянии или в виде соединений? Почему?
• ЩМ встречаются в природе только в составе соединений, ввиду своей высокой химии-ческой активности.
Натрий и калий широко распространены в природе, литий, рубидий и цезий — редкие элементы. Важнейшие природные соединения ЩМ:
NaCl — каменная соль; NaCl-KCl — сильвинит; Na2SO4.10H2O — глауберова соль, NaNO3 — селитра; KClMgCl2.6H2O — карналлит.
Соли ЩМ хорошо растворимы в воде (за исключением некоторых солей лития).
Распознавание ионов ЩМ по окраске пламени: Li+ — ярко-малиновый; Na+ — желтый; К+ — сине-фиолетовый.
Демонстрация. Следует учесть, что в присутствии даже небольшого количества ионов Na+ фиолетовый цвет маскируется желтым, в таком случае окрашивание пламени ионом К+ наблюдают через синее стекло.
V. Закрепление: Упр.1(а) с.58
Домашнее задание
§ 11, упр. 1(б), 5.
Листать вверх Листать вниз Скачивание материала начнется через 51 сек.
Ещё документы из категории химия:
Источник: https://doc4web.ru/himiya/konspekt-uroka-po-himii-schelochnie-metalli-klass.html
Щелочные металлы. Химия. 9 класс. Разработка урока

Тип урока: урок изучения и первичного закрепления нового материала с мультимедийной поддержкой. На уроке сочетаются фронтальный, групповой и индивидуальный виды работы учащихся.
Методы урока: проблемные, поисково-исследовательские, самостоятельная работа учащихся.
Оборудование:персональный компьютер с Windows Media Player, мультимедийный проектор, интерактивная доска, программы для запуска презентации на компьютере: MS Office Power Point, фрагменты из коллекции образовательных интернет ресурсов.
Цели урока
Образовательные:
- на основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов;
- проследить межпредметные связи химии с биологией, физикой, медициной, используя области применения основных соединений щелочных металлов;
- раскрыть значение и роль щелочных металлов в жизни человека.
Развивающие:
- способствовать дальнейшему развитию логического мышления учащихся: наблюдать, сравнивать химические элементы, высказывать суждения об их свойствах, обобщать, делать выводы;
- продолжить формирование навыков самообразования: умение работать с книгой, инструкцией, тестом.
Воспитательные:
- воспитание интереса к предмету и таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
План урока и распределение времени урока
- Организационный момент (1 мин)
- Вводное слово (2 мин)
- Актуализация знаний (5мин)
- Сообщение темы и плана урока (4 мин)
- Работа по плану объясняемой темы (23 мин)
- Закрепление: тестирование (8 мин)
- Домашнее задание (2 мин)
I. Организационный момент
Приветствие, проверка готовности к уроку учащихся (наличие тетрадей, учебников).
II. Вводное слово
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека.
На прошлых уроках мы рассмотрели общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов.
Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных щелочных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
III. Актуализация знаний учащихся в виде беседы по вопросам:
- На какие две большие группы происходит деление химических элементов?
- Где находятся металлы в ПСХЭ Д.И. Менделеева? (слайд №1)
- Каковы особенности строения атомов металлов?
- Как особенности строения атома влияют на физические свойства?
- Как особенности строения металлов влияют на их химические свойства?
IV. Сообщение темы и плана урока:
- Оформление даты и темы урока в тетрадях (слайд №2)
- Знакомство с планом урока (слайд №3):
- Положение щелочных металлов в ПСХЭ Д.И. Менделеева
- История открытия щелочных металлов
- Строение атомов химических элементов I группы главной подгруппы
- Физические свойства щелочных металлов
- Химические свойства щелочных металлов
- Биологическое значение щелочных металлов
- Подведение итогов: тестирование
- Домашнее задание
1. Положение щелочных металлов в ПСХЭ – беседа по вопросам: (слайд №4)
- Где располагаются щелочные металлы в ПСХЭ Д.И. Менделеева?
- Перечислите щелочные металлы.
- Почему данные металлы назвали щелочными?
2. История открытия щелочных металлов
Заранее подготовленный ученик рассказывает о хронологии открытия щелочных металлов и представляет свою презентацию темы (слайд №5):
- 1807 г. в Англии Гемфри Дэви открыл калий и натрий
- 1817 г. в Швеции Август Арфедсон открыл литий
- 1860 – 1861 г.г. в Германии Роберт Бунзен и Густав Кирхгоф открыли рубидий
- 1939 г. во Франции Маргарита Перей открыла радиоактивный элемент франций, который назвала в честь своей страны — Франции
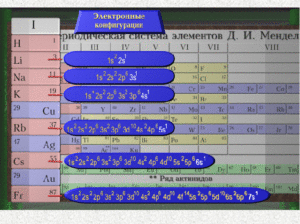
3. Строение атомов химических элементов I группы главной подгруппы
(Слайд №6): учащиеся заполняют таблицу: «Общая характеристика химических элементов I группы главной подгруппы» и делают выводы по заполненной таблице.
| Название и символ элемента | Состав атомного ядра | Число валентных электронов | Число энергетических уровней | Характерные степени окисления |
| Li – литий | p = 3, n = 4 | 1 | 2 | +1 |
| Na – натрий | p = 19, n = 20 | 1 | 3 | +1 |
| Rb – рубидий | p = 37, n = 48 | 1 | 4 | +1 |
| Cs – цезий | p = 55, n = 78 | 1 | 5 | +1 |
| Fr – франций | p = 87, n = 136 | 1 | 6 | +1 |
Выводы:
1) На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону (слайд №7)
2) В подгруппе от лития к цезию радиусы атомов увеличиваются, так как возрастает число электронных слоев, следовательно, усиливаются и восстановительные свойства
3) Во всех своих соединениях щелочные металлы проявляют степень окисления +1
Упражнение (слайд №8): сравните атомы элементов, поставив знаки >, < или = вместо *
I вариант
А) заряд ядра
Li * Rb ; Na * Al
Б) число электронных слоев
Li * Rb ; Na * Al
В) число электронов на внешнем уровне
Li * Rb ; Na * Al
Г) радиус атома
Li * Rb ; Na * Al
Д) восстановительные свойства
Li * Rb ; Na * Al
IIвариант
А) заряд ядра
K * Ca ; Na * Rb
Б) число электронных слоев
K * Ca ; Na * Rb
В) число электронов на внешнем уровне
K * Ca ; Na * Rb
Г) радиус атома
K * Ca ; Na * Rb
Д) восстановительные свойства
K * Ca ; Na * Rb
4. Физические свойства щелочных металлов (слайд №9–12)
Щелочные металлы – это простые вещества, для которых также, как и для всех металлов, характерна металлическая связь и металлическая кристаллическая решетка. Металлическая связь возникает за счет отдачи одного электрона атомом металла и образованием иона металла с положительным зарядом: М0 – 1е → М+1.
Наличие металлической связи и металлической кристаллической решетки обуславливает следующие физические свойства щелочных металлов: серебристо – белые, мягкие, обладают блеском, легкие, их плотность меньше 5 г/см3 и возрастает от лития к цезию, легкоплавкие, их температура, наоборот, от лития к цезию уменьшается.
5. Химические свойства щелочных металлов (слайды №13)
Щелочные металлы быстро окисляются на воздухе, поэтому их хранят под слоем керосина, а литий в вазелине, так как из-за своей легкости он в керосине всплывает.
Щелочные металлы активно взаимодействуют почти со всеми неметаллами (хлором, водородом, серой, кислородом). При взаимодействии с кислородом лития образуется оксид, а натрий и калий в данном случае образуют пероксиды. Все щелочные металлы активно реагируют с водой.
Скорость химических реакций зависит от природы реагирующих веществ: так, скорость реакции взаимодействия лития с водой меньше, чем натрия, и еще меньше, чем калия. Взаимодействие рубидия и цезия с водой протекает так быстро, что происходит.
Уравнения же реакций щелочных металлов с растворами кислот и солей записывать не принято (так как они взаимодействуют с водой).Упражнение (слайды №14): составить уравнения реакций взаимодействия с кислородом (приложение) (работа у доски)
I вариант:
А) лития
Б) натрия
II вариант:
А) калия
Б) лития
Реакцию Б) рассмотреть как ОВР: определить степени окисления, составить электронный баланс, расставить коэффициенты.
Упражнение (слайд №15): дать характеристику реакции Б) по плану (приложение) (самостоятельно)
План:
- По числу и составу исходных веществ и продуктов реакции (р.с., р.р., р.з., р.о.
- По изменению степеней окисления атомов (ОВР и не ОВР)
- По направлению (обратимые и необратимые)
- По тепловому эффекту (экзотермические и эндотермические)
- По агрегатному состоянию (гомогенные и гетерогенные)
- По использованию катализатора (каталитические и некаталитические)
I вариант
1) Число электронов на внешнем уровне у атомов щелочных металлов:
А) 1
Б) 2
В) 3
Г) 4
2) Тип химической связи в простом веществе литии:
А) ионная
Б) ковалентная полярная
В) ковалентная неполярная
Г) металлическая
3) Распределение электронов по энергетическим уровням в атоме лития:
А) 2е, 3е
Б) 2е, 4е
В) 2е, 8е, 1е
Г) 2е, 8е, 3е
4) Наименее энергично взаимодействует с водой:
А) калий
Б) литий
В) натрий
Г) рубидий
5) Простое вещество с наиболее ярко выраженными металлическими свойствами:
А) калий
Б) литий
В) натрий
Г) рубидий
II вариант
1) Вид химической связи в простом веществе натрии:
А) ионная
Б) ковалентная полярная
В) ковалентная неполярная
Г) металлическая
2) Радиус атомов элементов I группы главной подгруппы с увеличением заряда ядра:
А) изменяется периодически
Б) не изменяется
В) увеличивается
Г) уменьшается
3) Распределение электронов по энергетическим уровням в атоме лития:
А) 2е, 3е
Б) 2е, 1е
В) 2е, 4е
Г) 2е, 8е, 1е
4) Наиболее энергично взаимодействует с водой:
А) калий
Б) литий
В) натрий
Г) цезий
5) Простое вещество с наименее выраженными металлическими свойствами:
А) калий
Б) литий
В) натрий
Г) рубидий
VII. Домашнее задание (слайд №16)
Учебник: § 11 (стр. 52 – 54) вопрос №1 а (стр. 58)
Источники информации:
- Химия. 9 класс: учебник для общеобразовательных учреждений / О.С. Габриелян – М.: Дрофа, 2010
- Настольная книга учителя. Химия, 9 класс /О.С. Габриелян, И.Г. Остроумов – М.: Дрофа, 2002
- Химия. 9 класс: рабочая тетрадь к учебнику О.С. Габриелян «Химия. 9 класс»/ О.С. Габриелян, А.В. Яшукова — М.: Дрофа, 2008
- Коллекция образовательных интернет ресурсов http://school-collection.edu.ru/catalog/teacher/
- Химия. 9 класс: контрольные и проверочные работы к учебнику О.С. Габриелян «Химия. 9 класс»/ О.С. Габриелян, П.Н. Березкин и др. — М.: Дрофа, 2007
Источник: https://rosuchebnik.ru/material/schelochnye-metally-himiya-9-klass-razrabotka-uroka/
Урок по химии для 9-го класса

- Колодиева Оксана Александровна, учитель химии
Разделы: Химия
Тема
: Щелочные металлы.
Цель
: На основе атомного строения металлов,
физических и химических свойств, показать черты
сходства и различия щелочных металлов,
межпредметные связи химии с биологией, физикой,
медициной используя области применения основных
соединений щелочных металлов, роль этих металлов
в жизни человека.
Совершенствовать умения наблюдать, сравнивать
химические элементы, высказывать суждения об их
свойствах, делать выводы.
Методы
: проблемный, частично-поисковый,
лабораторная работа.
Оборудование
: персональный компьютер.
2. Объяснение нового материала
а). Тема, план урока и основные вопросы написаны
на доске.
План.
б). Учащиеся работают с презентацией, на
индивидуальном листе (приложение
1), ведется дискуссия и анализ учебного
материала.
Учитель объявляет тему урока и совместно с
учениками формулирует цель урока (слайд №1 и №2).
Затем, учитель ставит проблемные вопросы (они
заранее записаны на доске), на которые учащиеся
ищут ответы в процессе изучения новой темы.
Вопросы.
в). Учащиеся сравнивают электронное строение
элементов щелочных металлов (слайд №3).
| Название элемента | Знак | Порядковый номер | Относительная атомная масса,Аr | Количество электронов на внешнем уровне | Степень окисления |
| ЛИТИЙ | Li | 3 | 7 | 1 | +1 |
| НАТРИЙ | Na | 11 | 23 | 1 | +1 |
| КАЛИЙ | K | 19 | 39 | 1 | +1 |
| РУБИДИЙ | Rb | 37 | 85 | 1 | +1 |
| ЦЕЗИЙ | Cs | 55 | 133 | 1 | +1 |
| ФРАНЦИЙ | Fr | 87 | 223 | 1 | +1 |
Учащиеся делают вывод, о том, что у всех
элементов одинаковое количество электронов на
внешнем уровне, и они проявляют одинаковую
степень окисления.
г). Учащиеся узнают об истории открытия
щелочных металлов (слайд №4).
“ В 1807г. в Англии Г.Деви открыл натрий и калий:
“натрун” — сода, “алкали” — щелочь.
В 1817г. в Швеции А.Арфедсон открыл литий:
“литос” — камень.
В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф
открыли рубидий “темно-красный” и цезий
“небесно-голубой”.
В 1939г. во Франции М.Пере открыл радиоактивный
элемент франций, который назвал в честь своей
страны.
д). Физические свойства щелочных металлов.
Слайд №5 содержит видеоролики, которые
показывают внешнее строение металлов лития и
натрия, калия и цезия.
Затем учащиеся сравнивают физические
показатели плотности металлов и температуры
плавления. Делают вывод о зависимости
температуры плавления от плотности металла.
| Li | Na | K | Rb | Cs | |
| Плотность металла, г/см3 | 0,5343 | 0,971 | 0,863 | 1,532 | 2,44 |
| Температура плавления, 0С | 180 | 98 | 64 | 39 | 27 |
е). Лабораторная работа (слайд №7). Слайд
содержит гиперссылки на видеоролики, которые
показывают основные химические свойства
щелочных металлов. Учащиеся просматривают
видеоролики, анализируют опыты, записывают в
индивидуальном листе (Приложение
1) результаты увиденного, химические
уравнения.
Данную работу можно провести и
лабораторно–демонстрационной.
Оборудование: чашка Петри, газовая
горелка, нихромовая петля, лабораторный нож.
Вещества: натрий, калий, литий, вода,
хлорид натрия, хлорид калия, хлорид лития.
Цель: провести реакции,
подтверждающие химические свойства щелочных
металлов.
Опыт № 1 . Взаимодействие натрия с кислородом.
Опыт № 2.Взаимодействие натрия с водой.
Опыт № 3. Взаимодействие лития, натрия, калия с
водой.
Опыт № 4. Горение солей лития.
Опыт № 5. Горение солей натрия.
Опыт № 6. Горение солей калия.
Химические уравнения реакций:
2Na + O2 = 2Na2O
2Na + 2H2O = 2NaOH + H2
2K + 2H2O = 2KOH + H2
Вывод: (каждый учащийся делает самостоятельно)
Информационная часть урока:
1. Учитель рассказывает о самых
распространенных соединениях щелочных металлов
и их применении (слайде № 8).
NaOH – едкий натр, каустическая сода.
KOH – едкое кали
Na2CO3*10H2O – кристаллическая сода
NaHCO3 – пищевая сода
K2CO3 – поташ
Na2SO4*10H2O – глауберова соль
производства бумаги, мыла, волокон, стекла,
удобрений. Применяются в медицине и
фармакологии.
2.Учитель рассказывает о применении поваренной
соли (слайде №9):
Поваренную соль используют для получения
натрия, хлора, гидроксида натрия, соляной
кислоты, соды. Применяют в пищевой
промышленности, при производстве мыла.
3. Учитель рассказывает о биологической роли
натрия и калия (слайде №10).
Ион натрия
– внутриклеточный ион, который
содержится в крови и лимфе, создаёт в клетках
осмотическое давление.
Ион калия
– внеклеточный ион, который
поддерживает работу сердца и мышц.
Большое количество калия содержится в кураге,
сои, фасоли, зеленом горошке, черносливе, изюме.
После просмотра слайдов №8 — 10, учащиеся
подводят итог урока, отвечают на вопросы,
поставленные в начале урока.
.
Для закрепления изученного материала, учащиеся
выполняют игровые задания (слайд № 11,12).
1. Определите “лишний” элемент в ряду
а) Fr, K, Cu, Na;
б) P, Li, O, Cl;
в) Al, Ag, Ra, Cs.
Объясните свой выбор.
2. Игра “Крестики – нолики”.
1. Какой металл при взаимодействии с водой
образует щелочь?
| Si | Na | Fr |
| Cu | Li | Pb |
| Cs | Zn | K |
2. Определите электронные формулы щелочных
металлов
| 4s2 | 1s1 | 2s2 |
| 3s1 | 6s1 | 2s1 |
| 3s23p1 | 4s1 | 6s2 |
Тест предназначен для индивидуального
контроля усвоения новых знаний. (Приложение
2)
После выставления учащиеся записывают
домашнее задание.
§ 11, задание 1 (письменно), 3 (устно) (слайд №13)
Конец урока.
Презентация
6.03.2008
Источник: https://xn--i1abbnckbmcl9fb.xn--p1ai/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/510225/
Урок по химии для 9-го класса Щелочные металлы
27.04.2017
- Колодиева Оксана Александровна, учитель химии
Тема
: Щелочные металлы.
Цель
: На основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов, межпредметные связи химии с биологией, физикой, медициной используя области применения основных соединений щелочных металлов, роль этих металлов
в жизни человека.
Совершенствовать умения наблюдать, сравнивать химические элементы, высказывать суждения об их
свойствах, делать выводы.
Методы
: проблемный, частично-поисковый,
лабораторная работа.
Оборудование
: персональный компьютер.

